「還」保聚「膠」──探討果膠水解以及其產物的抗氧化能力
組員:沈楷博、范植翔
摘要
柑橘類水果所含營養價值高,而其果皮更能萃取出許多果膠。本實驗主要研究臺灣非常獨特的水果──文旦以及本地柑橘之果皮中果膠水解狀況,探討主題包含果皮萃取物中所含果膠之比例,以及果膠進行酸水解形成醛類的最佳環境、水解產物所具備之抗氧化能力。
研究發現,由我們參考資料做些許調整的自製果膠提煉法所製成成品,與市售果膠成分幾乎一致,而以稀酸水解的結果中,溫度攝氏90度,時間30分,酸的種類鹽酸 0.1 M ( [H+] = 0.2 N ) 為水解效果最佳的三個條件。氧化還原測定經由亞甲藍藍瓶實驗測得果膠水解產物具還原性,並且還原力與斐林實驗結果為正相關,顯示其醛基在水解時從聚合物可被釋放。未來希望能使果膠在保存食品上做相關應用,並藉此將植物廢棄物再利用於日常生活中的食品科學及加工,達到環境保護的目的。
研究動機
在中秋佳節中,柚子是不可或缺的應景水果,在享用水果時,我們發現果肉和果皮中含膠狀物質,原來這黏稠的物質便是常用於食品加工及烘焙坊蛋糕上的「果膠」。我們得知果膠可以應用於去除重金屬、製成藥物外,更想了解在精緻的蛋糕上所添加之天然果膠除了美觀之外,會不會有抗氧化能力而可以保存食物呢?我們進一步了解了果膠的結構,發現其為D-半乳糖醛酸之聚合物,我們想要探究經過水解後的果膠產物能在延長食物腐壞上產生之效果。
果膠在酵素或酸性環境下可大量水解成D-半乳糖醛酸,而我們在應用生物課中看到在生產醬油時使用酸水解將產量提高,再加上我們查詢到果膠在果肉含量甚高,市面上的果膠都常使用水果果肉提煉,但這樣不僅耗費食物,使生產成本居高不下,製造過程所產生的廢棄物也沒有加以回收利用。我們想到果膠聚集於細胞壁中,若可以利用剩餘被丟棄的果皮有效地提煉果膠並水解出具保護功能的產物,不僅能減少有機廢棄物的生成,更能推廣果膠的大量製造與使用,降低成本又愛護環境,真是益處良多。
研究目的
(一) 研究從柑橘果皮中提煉的果膠與市售果膠比較
(二) 尋找果膠在不同酸溶液中水解之效率
(三) 尋找果膠在不同pH值之溶液中水解之效率
(四) 尋找果膠在不同溫度之溶液中水解之效率
(五) 尋找果膠在水解時間不同之效率
(六) 對比果膠水解產物與強還原劑之抗氧化性
背景知識
果膠的性質:
果膠(pectin),是一類天然高分子化合物,果膠的分子量通常為60,000-130,000g / mol,它主要存在於植物中,是植物細胞間質的重要成分,而果實中又以蘋果及柑橘含量最多,果膠生產的主要原料是乾柑橘皮或蘋果渣,這兩種都是果汁生產的副產品。在適宜條件下果膠溶液能形成凝膠和部分發生甲酯化。果膠耐熱性強,幾乎不溶於乙醇及其他有機溶劑。
果膠最初是由Henri Braconnot在1825年分離的,為了從果實中含有少量或僅有低質量果膠的果實中獲得良好的果醬,將富含果膠的果實或其提取物混合到配方中。現在,果膠在生活中通常製成果膠粉,呈黃色或白色的粉末狀,具有凝膠、增稠及乳化等作用。果膠也是一種天然的食物添加劑,為製造果醬、果凍、優酪乳及雪糕等,可以減少糖和麵粉的使用量,減少身體負擔,此外果膠也可為水果保鮮之用。
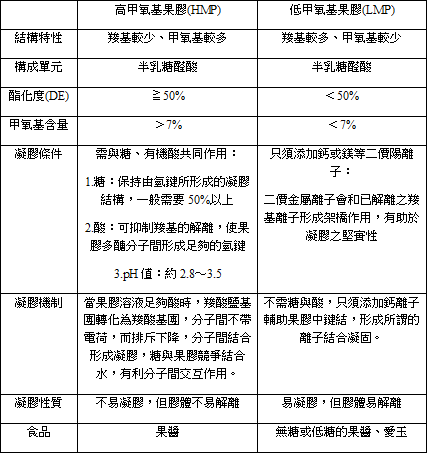
果膠主要可分為兩類:高甲氧基果膠(HMP)、低甲氧基果膠(LMP)。在自然界中,大約80%的羧基的半乳糖醛酸被甲醇酯化。在果膠提取過程中,該比例降低到不同之程度。酯化與非酯化半乳醣醛酸的比例決定了果膠的食品應用。
酸水解及產物:
酸水解為一種分解聚合物成為單體的方法,果膠主要為D-半乳糖醛酸之聚合物,它的分子式為(C6H10O7 )n,水解之方法為酵素水解及酸水解,本實驗中使用後者,果膠水解時會產生D-半乳糖醛酸,若繼續反應則有可能產生副產物包含甲酸、果糖酸、甲基糠醛等,其中全部產物中有含有醛基之物質,已知醛基可進行氧化還原反應行成羧基,因此醛具有還原性,反應式如下: $$ RCHO + [O] \longrightarrow RCOOH $$
硫酸為最穩定的水解酸,但在水解水溶液酸濃度10N時酸度過高,不僅不易中和,更可能在水解後進行其他實驗時果膠水解產物遭到破壞,總而言之做不出任何結果。而草酸則可能會在加熱過高溫時分解,且水的溶解度較低,我們在進行果膠水解時使用較濃草酸容易因草酸結晶沉澱造成實驗上的困難。鹽酸的部分阻礙較少,實驗上較無問題。
斐林試劑實驗原理:
斐林試劑可以用來區分水溶性的醛及酮官能基。試劑中的二價雙酒石酸鹽負離子螯合物為氧化劑和此檢測中的活化劑。將待測試的物質加入斐林試劑中混合並共熱,醛由於具有還原力,在與斐林試劑混合併共熱後,二價雙酒石酸鹽負離子會去氧化羧酸陽離子,在這個過程中螯合物的銅(II)可以被它所還原,生成磚紅色的氧化亞銅 (Cu2O)沉澱,同時醛被氧化為羧酸。
藍瓶實驗原理:
亞甲藍還原反應又稱為藍瓶反應,亞甲藍氧化態時為藍色,UV光譜儀峰值約於665nm,還原態時為無色,因此可用於測試還原劑之能力。
實驗步驟
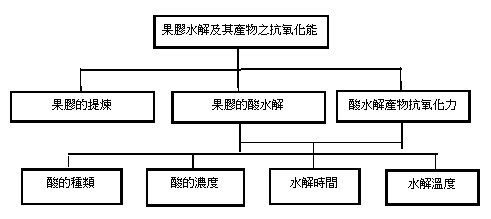
柑橘皮果膠之提煉與檢驗
(一)步驟:
1. 提煉果膠之方法使用100g柑橘皮浸入500ml 0.1MHCl於燒杯中,使用加熱板煮至沸騰,將果皮完全浸入溶液並持續1小時,以溶出果皮中之萃取物。
2. 將萃取液冷卻後以抽濾方式進行過濾雜質,使用抽濾機較一般濾紙過濾快且純化效果好。
3. 將過濾後的濾液以95%乙醇清洗,再用80%乙醇清洗共三次以上,確保果皮之色素溶於酒精,而果膠由於遇到乙醇會凝結成凍,不溶於色素液中,藉此特性將兩者分離。
提取方法可使用醇類或金屬鹽類提取,但傳統的金屬鹽類提取法容易產生雜質,故醇類提取較佳。
4. 最後再用純水洗淨含乙醇之果膠,利用抽濾機除水乾燥,在放入溫度攝氏60度之烘箱繼續烘乾,使其含水量降低。
5. 將成品秤重,可得自柑橘果皮萃取出之果膠含量百分比。



(二)檢驗:FTIR 傅立葉轉換紅外線光譜儀
1. 將果膠倒入容器中,加入液態氮使其容易磨碎,用杵研磨至氮氣釋放完畢。
2. 將樣品以攝氏150度真空烘箱烘至脫水。
3. 取一部分放入瑪瑙研砵,再加入些許溴化鉀於其中,搖晃均勻後以杵研磨,磨成粉狀後收集起來。
4. 把13mm KBr die取出,把小鋼柱亮面朝上,平滑放入13mm KBr die中。
5. 利用刮杓把研磨的樣品粉末平均分布於13mm KBr die中,再將長形圓柱全平面朝下,慢慢壓入。
6. 油壓機定位後,把13mm KBr die放入油壓機中正確的位置,把上方壓力旋扭順時針旋轉使鋼柱下壓,至die上扭緊。
7. 開始握住壓力搖桿,慢慢施加壓力,注意壓力表上的指針,施壓至5 - 10間,一般以指針至刻度7為最合適,在靜待2 – 3分鐘後洩壓,取出所打的KBr disk。
8. 以刮杓取KBr disk放入13mm KBr Holder中,放入儀器的樣品槽中開始測試樣品。
自製果膠經不同條件下酸水解之效果
本實驗以不同之環境下探討果膠酸水解之成效,水解流程如下:
1. 取0.5g自製果膠於燒杯
2. 溶於10ml酸溶液
3. 放於加熱板上,攪拌子轉速300RPM,控制不同溫度以及時間
結果以斐林試劑檢驗。斐林試劑分為A、B劑,A劑由3.464g的五水合硫酸銅溶於50ml蒸餾水中得到,B劑由17.3g的四水合酒石酸鉀鈉和6g氫氧化鈉溶於50ml蒸餾水中得到,兩者在使用時混合,反應時需在鹼性環境之下。斐林試劑與醛或酮反應形成氧化亞銅,秤氧化亞銅之重量便可得知樣品含醛基之量。
步驟:
1. 將樣品:A:B=1:1:1比例倒入離心管混合,放入熱水水浴3~5分鐘。
2. 使用離心機離心3000~4000轉5分鐘,離完把剩餘液倒入廢液桶。
3. 每次離心後加5cc水繼續離心重複3~4次,殘留之果膠固體將被溶解去除。
4. 完成後移至烘箱烘乾,測量氧化亞銅沉澱重量。

果膠水解產物的還原力測定
測定還原性的方法有許多種,不過受限於未水解完的殘留果膠為一聚合物,無法使用如過錳酸鉀等強氧化劑以進行。
另外,我們嘗試設計一套使用將氯化鐵還原,與苯酚混合觀察顏色變化的實驗,當氯化鐵和苯酚反應時會顯現紫色,還原成功則不會反應,卻因果膠水解溶液呈現酸性,導至苯酚走向其他反應,無法測出剩下的氯化鐵與苯酚反應的結果。
後來我們使用赤血鹽測定還原力的方式,該方法為樣品將赤血鹽轉換為黃血鹽,加入磷酸鹽緩衝溶液、三氯乙酸、氯化鐵,亞鐵氰酸鉀與三價鐵因為結合而產生普魯士藍,但使用水解產物或是同濃度的葡萄糖液皆無法使赤血鹽還原並與氯化鐵形成普魯士藍,形成實驗上的瓶頸。我們認為過錳酸鉀、苯酚顯色及赤血鹽實驗在果膠水解產物抗氧化能力的測定上無法發揮作用。
我們後來採用亞甲藍液以UV光譜儀進行測驗,亞甲藍在接觸還原劑會被還原,藍色將轉化為無色,經過光譜儀測量可得到亞甲藍在一小時內的反應狀況,也是我們目前最可行的方法。
步驟:
1. 在比色管中加入0.5ml 10-4M亞甲藍以及3.5ml樣品,使用UV光譜儀檢測。
2. 記錄在665nm時的數據及圖形
實驗數據
自製果膠與市售純果膠比對
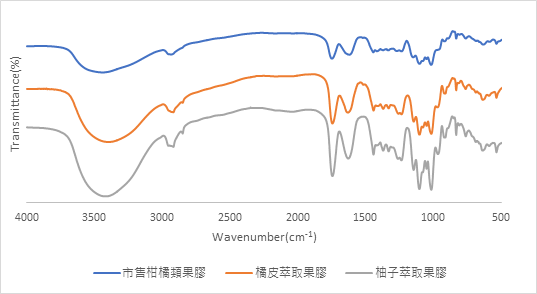
根據其特殊波峰推斷是否具有相同官能基,若圖形相同即是一樣的物質
在900、600處的波形,我們自製的果膠有相似波峰及波谷,但是市售純果膠比較沒那麼明顯,2700也有和市售不一樣的,多了一個凹陷的小角,而其它部分基本上是吻合的,只差在製程薄膜時的技術差異,造成訊號強弱的問題(膜太厚訊號變弱)。
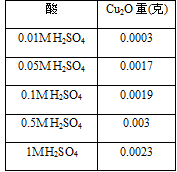
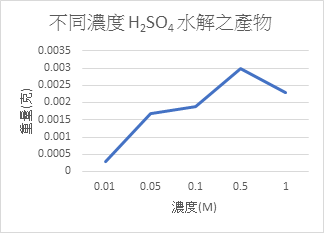
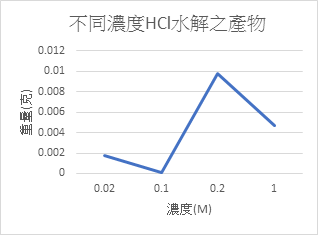
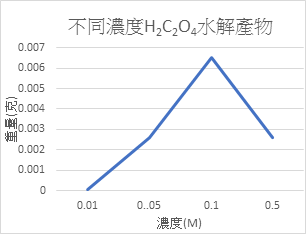
不同濃度的酸對果膠水解產物的影響


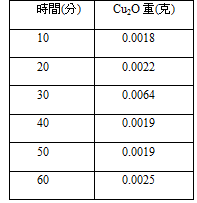
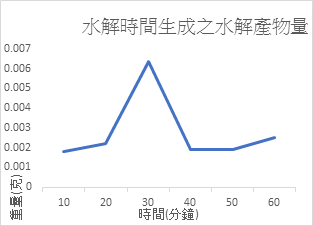
不同時間對於果膠水解的影響
控制變因:柚皮果膠0.5g + 10ml H2SO4,攝氏100度
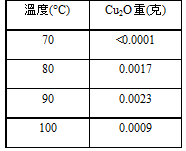
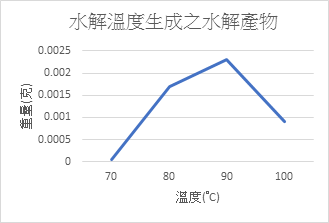
不同溫度對果膠水解的影響
控制變因:橘皮果膠0.5g+10mlH2SO4,60分鐘
果膠水解產物的還原力測定
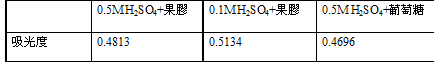
亞甲藍吸收度: 0.6447
經過計算,果膠讓亞甲藍濃度下降25.6%,而葡萄糖使其下降30.3%左右
葡萄糖克數*葡萄糖每克還原能力(R1) : 果膠克數*果膠每克還原能力(R2)=30.3% : 25.6%
0.186*3.5*10-3*180*25.6/30.3=(R2/R1)*0.5*3.5/10
R2/R1= 0.559
得到果膠的還原能力約為葡萄糖還原能力的 0.56倍
討論
自製果膠與市售純果膠比對
根據其特殊波峰推斷是否具有相同官能基,若圖形相同即是一樣的物質
在900、600處的波形,我們自製的果膠有相似波峰及波谷,但是市售純果膠的形在此處比較沒那麼明顯,自製果膠在2700處也有和市售不一樣的,多了一個凹陷的小角,而其它部分基本上是吻合的,只差在製程薄膜時的技術差異,造成訊號強弱的問題可能膜太厚影響穿透,訊號變弱。
不同濃度的酸對果膠水解產物的影響
就我們所選的酸的情況下來看,在H+介於1M~0.2M時的水解量普遍比其他的還要高。濃度太低水解量會變非常稀少,而濃度過高就目前看起來產率也是沒有1M~0.2M的多。我們沒做更濃的酸去水解是因為在和過濃的酸水解後,會讓本來應該微微混濁的溶液變黃色,也會跑出奇怪的懸浮物,因此先決定不做。
我們也無法比較不同酸的水解產率,因為無法定量濕果膠的純果膠比例(分不同天做的),只能先求出趨勢線。未來會嘗試以乾果膠來定量比較。
不同時間對於果膠水解的影響
比起我們實驗一貫水解果膠60分鐘,我們發現水解30分鐘能得到最多的水解產物。經過查閱資料,發現在水解過久的情況下會產生副產物,反而消耗掉我們的目標產物。而且這時我們還是定100°C為我們的水解溫度,推測為是水分蒸發,造成酸的濃度提升,而影響結果。
不同溫度對果膠水解的影響
從實驗數據中可以看出,低於70°C時幾乎就測不到Cu2O的重量,應是溫度不足以水解果膠,或是實驗上的誤差,反應出來的量本來就很少,可能要再測試以確定是否真的是溫度太低。而在90°C時會有最好的水解量,反而到了100°C時水解量減少許多,由此可知最好的水解量介於80~90°C,前面和斐林試劑反應量少應是水解溫度的影響。
果膠水解產物的還原力測定
藉由其被還原呈現無色的特性,以光譜儀測定其降解情況。果膠其實在隨時間還原亞甲藍的情況並不明顯,而且亞甲藍濃度時高時低。而由於果膠水解溶液本身在665nm處也有吸收度,在互相扣除,發現的確0.5M和0.1M都是有下降的情況,而0.5M降解亞甲藍的情形較0.1M的好。但是基本上加進去沒多久後就會反應的差不多,因此造成亞甲藍的吸收時高時低,不是穩定下降的趨勢。在葡萄糖溶液中也看得出加下去就反應差不多的現象。不過不同的是葡萄糖有穩定些微降低,而果膠就維持在其一開始的數值左右,我們認為是水解量太少所導致的。其實多數的氧化還原指示劑通常都會控制在鹼性環境下,讓氧化還原電位降低,讓還原劑的效果能較為顯著。然而果膠水解物貌似只能溶於酸性液體中,一旦為了提高pH值而加過量的鹼性物質,反而又會將果膠水解物析出。不過在一開始確實能看到數值下降的情況。因此我們認為果膠具有一定的還原性,只是還原的多寡還要再跟葡萄糖進行比對。
結論
一、 自製果膠經由FTIR檢驗確定應為同樣的東西,只是量的多寡還要進行檢定。
二、 就目前實驗數據來看,H2SO4在1N時有最好的水解量,HCl和H2C2O4則是在0.2N~1N之間,未來會在是看看更濃的酸的情形。
三、 在水解30分鐘的情況下會有最大的水解量
四、 低於70°C時幾乎就測不到Cu2O的重量,而到了90°C時會有最好的水解量,到了100°C時水解量明顯降低,由此可知最好的水解量介於80~90°C。
五、 目前已經試過多種方法測驗其還原性,但多數都會被酸鹼所影響,因此無法確切看出明顯的趨勢。但大概能從亞甲藍的實驗中確認了果膠水解物有還原的能力,只是在酸性環境加上量少的關係,無法完全反應掉亞甲藍。
參考資料
黃尚銘(2011年11月29日)‧果膠HMP與LMP之比較‧公職食品技師高考‧取自 http://koulifood.blogspot.com/2011/11/hmplmp.html
游春祥、王伯丞、楊馥誠、吳靖則、林哲廷(2009) 斐夷所思(Fehling's Test 的迷失一環)‧宜蘭高中 98 學年度學生數理自然科學專題研究‧取自 http://blog.ylsh.ilc.edu.tw/life/gallery/45/%E8%87%AA%E7%84%B63-%E6%96%90%E5%A4%B7%E6%89%80%E6%80%9D.pdf
葉嘉雯(2015年12月10日)‧3D有趣實驗:變色搖搖瓶‧科學Online高瞻自然科學教學資源平台‧取自 http://highscope.ch.ntu.edu.tw/wordpress/?p=66831
Nicole Kreuziger Keppy& Michael W. Allen, Ph.D. Analysis of Methylene Blue Reduction by Ascorbic Acid. Thermo Fisher Scientific,51867.Retrieved 2010,from http://www.acm2.com/prilojenia/UV-VIS_Applications/MethyleneBlue%20analysis.pdf